Гормональный ад и рай: откуда берутся гормоны
Экология здоровья: Что такое гормоны, все более или менее представляют. До недавнего времени было принято считать, что их синтезируют эндокринные железы или специализированные эндокринные клетки
Зубной гормон
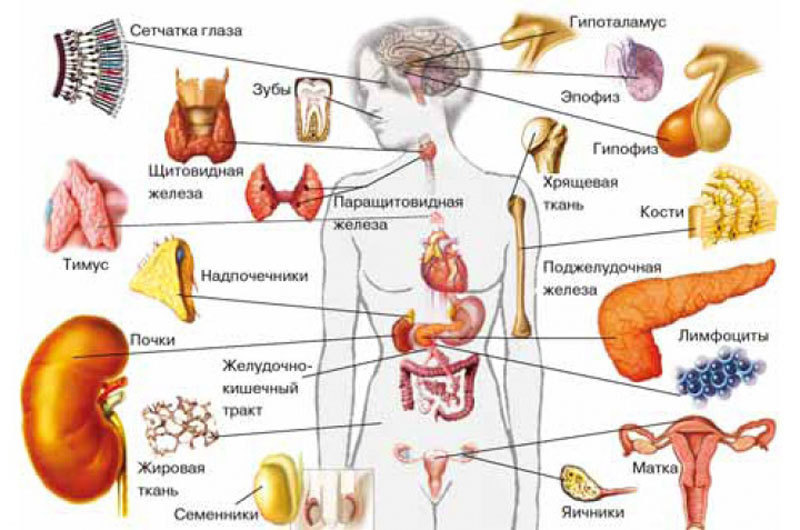
Что такое гормоны, все более или менее представляют. До недавнего времени было принято считать, что их синтезируют эндокринные железы или специализированные эндокринные клетки, разбросанные по всему организму и объединенные в диффузную эндокринную систему. Клетки диффузной эндокринной системы развиваются из того же зародышевого листка, что и нервные, потому называются нейроэндокринными. Где их только не находили: в щитовидной железе, мозговом веществе надпочечников, гипоталамусе, эпифизе, плаценте, поджелудочной железе и желудочно-кишечном тракте. А недавно их обнаружили в пульпе зуба, причем оказалось, что количество нейроэндокринных клеток в ней меняется в зависимости от здоровья зубов.
Честь этого открытия принадлежит Александру Владимировичу Московскому, доценту кафедры ортопедической стоматологии Медицинского института при Чувашском государственном университете им. И. Н. Ульянова. Нейроэндокринные клетки отличаются характерными белками, и их можно выявить иммунологическими методами. Именно так А. В. Московский их и обнаружил. (Это исследование опубликовано в № 9 «Бюллетеня экспериментальной биологии и медицины» за 2007 год.)
Пульпа — мягкая сердцевинка зуба, в которой находятся нервы и кровеносные сосуды. Ее извлекали из зубов и приготовляли срезы, на которых затем искали специфические белки нейроэндокринных клеток. Делали это в три этапа. Сначала подготовленные срезы обрабатывали антителами к искомым белкам (антигенам). Антитела состоят из двух частей: специфической и неспецифической. После связывания с антигенами они остаются на срезе неспецифической частью вверх. Срез обрабатывают антителами к этой неспецифической части, которые помечены биотином. Затем этот «бутерброд» с биотином сверху обрабатывают специальными реагентами, и место локализации исходного белка проявляется как красноватое пятнышко.
Нейроэндокринные клетки отличаются от клеток соединительной ткани более крупными размерами, неправильной формой и наличием в цитоплазме красновато-коричневых глыбок (окрашенных белков), нередко закрывающих ядро.
В здоровой пульпе нейроэндокринных клеток немного, но при кариесе их количество возрастает. Если зуб не лечить, то болезнь прогрессирует, а нейроэндокринных клеток становится все больше, причем они скапливаются вокруг очага поражения. Пик их численности приходится на кариес столь запущенный, что воспаляются и ткани вокруг зуба, то есть начинается пародонтит.
У пациентов, которые предпочитают долго мучиться дома, чем один раз сходить к врачу, развивается воспаление пульпы и пародонта. На этой стадии количество нейроэндокринных клеток уменьшается (хотя их все равно больше, чем в здоровой пульпе) — их вытесняют клетки воспаления (лейкоциты и макрофаги). Снижается их численность и при хроническом пульпите, но при этом заболевании клеток в пульпе вообще остается мало, им на смену приходят склеротические тяжи.
По мнению А. В. Московского, нейроэндокринные клетки при кариесе и пульпите регулируют в очаге воспаления процессы микроциркуляции и метаболизма. Поскольку нервных волокон при кариесе и пульпите тоже становится больше, эндокринная и нервная системы и в этом вопросе действуют сообща.
Гормоны везде?
В последние годы ученые выяснили, что производство гормонов — отнюдь не прерогатива специализированных эндокринных клеток и желез. Этим занимаются и другие клетки, у которых множество других задач. Их список растет год от года. В него попали различные клетки крови (лимфоциты, эозинофильные лейкоциты, моноциты и тромбоциты), ползающие вне кровеносных сосудов макрофаги, клетки эндотелия (выстилки кровеносных сосудов), эпителиальные клетки тимуса, хондроциты (из хрящевой ткани), клетки амниотической жидкости и плацентарного трофобласта (той части плаценты, которая врастает в матку) и эндометрия (это из самой матки), клетки Лейдига семенников, некоторые клетки сетчатки и клетки Мер-келя, расположенные в коже вокруг волос и в эпителии подногтевого ложа, мышечные клетки. Список синтезируемых ими гормонов тоже довольно длинный.
Взять, к примеру, лимфоциты млекопитающих. Помимо положенной им продукции антител, они синтезируют мелатонин, пролактин, АКТГ (адренокортикотропный гормон) и соматотропный гормон. «Родиной» мелатонина традиционно считают эпифиз — железу, расположенную у человека в глубине мозга. Синтезируют его и клетки диффузной нейроэндокринной системы. Спектр действия мелатонина широк: он регулирует биоритмы (чем особенно знаменит), дифференцировку и деление клеток, подавляет рост некоторых опухолей и стимулирует выработку интерферона. Пролактин, вызывающий лактацию, вырабатывает передняя доля гипофиза, но в лимфоцитах он действует как фактор роста клеток. АКТГ, который также синтезируется в передней доле гипофиза, стимулирует синтез стероидных гормонов коры надпочечников, а в лимфоцитах регулирует образование антител.
А клетки тимуса, органа, в котором образуются Т-лимфоциты, синтезируют лютеинизирующий гормон (гормон гипофиза, вызывающий синтез тестостерона в семенниках и эстрогенов в яичниках). В тимусе он, вероятно, стимулирует клеточное деление.
Синтез гормонов в лимфоцитах и клетках тимуса многие специалисты рассматривают как доказательство существования связи между эндокринной и иммунной системами. Но это еще и весьма показательная иллюстрация современного состояния эндокринологии: нельзя сказать, что некий гормон синтезируется там-то и делает то-то. Мест его синтеза может быть много, функций тоже, и часто они зависят именно от места образования гормона.
Эндокринная прослойка
Иногда скопление неспецифических гормонопроизводящих клеток образует полноценный эндокринный орган, и немаленький, такой, например, как жировая ткань. Впрочем, размеры его переменны, и в зависимости от них меняются спектр «жировых» гормонов и их активность.
Жир, доставляющий современному человеку столько неприятностей, на самом деле представляет собой ценнейшее эволюционное приобретение.
В 1960-е годы американский генетик Джеймс Нил сформулировал гипотезу «бережливых генов». Согласно этой гипотезе, для ранней истории человечества, да и не только для ранней, характерны периоды продолжительного голодания. Выживали те, кто в промежутках между голодными годами успевал отъедаться, чтобы потом было чем худеть. Поэтому эволюция отбирала аллели, которые способствовали быстрому набору веса, а также склоняли человека к малой подвижности — сидючи, жир не растрясешь. (Генов, которые влияют на стиль поведения и развитие ожирения, известно уже несколько сотен.) Но жизнь изменилась, и эти внутренние запасы нам теперь не впрок, а к болезни. Избыток жира вызывает тяжкий недуг — метаболический синдром: комбинацию ожирения, устойчивости к действию инсулина, повышенного артериального давления и хронического воспаления. Пациенту с метаболическим синдромом недолго ждать сердечно-сосудистых заболеваний, диабета второго типа и множества других недугов. И все это — результат действия жировой ткани как эндокринного органа.
Основные клетки жировой ткани, адипоциты, совсем не похожи на секреторные клетки. Однако они не только запасают жир, но и выделяют гормоны. Главный из них, адипонектин, предотвращает развитие атеросклероза и общих воспалительных процессов. Он влияет на прохождение сигнала от рецептора инсулина и тем самым препятствует возникновению инсулинрезистентности. Жирные кислоты в клетках мышц и печени под его действием окисляются быстрее, активных форм кислорода становится меньше, а диабет, если он уже есть, протекает легче. Более того, адипонектин регулирует работу самих адипоцитов.
Еще один замечательный гормон жировой ткани — лептин. Как и адипокинетин, его синтезируют адипоциты. Лептин известен тем, что подавляет аппетит и ускоряет расщепление жирных кислот. Такого эффекта он достигает, взаимодействуя с определенными нейронами гипоталамуса, а уж дальше гипоталамус сам распоряжается. При избыточной массе тела продукция лептина увеличивается в разы, а нейроны гипоталамуса снижают к нему чувствительность, и гормон бродит по крови несвязанный. Поэтому, хотя уровень лептина в сыворотке больных ожирением повышен, люди не худеют, поскольку гипоталамус его сигналы не воспринимает. Однако рецепторы к лептину есть и в других тканях, их чувствительность к гормону остается на прежнем уровне, и они охотно реагируют на его сигналы. А лептин, между прочим, активирует симпатический отдел периферической нервной системы и повышает кровяное давление, стимулирует воспаление и способствует образованию тромбов, иными словами, вносит посильную лепту в развитие гипертонии и воспаления, свойственных метаболическому синдрому.Казалось бы, адипонектин незаменим при ожирении и может предотвратить развитие метаболического синдрома. Но, увы, чем сильнее разрастается жировая ткань, тем меньше гормона она производит. Адипонектин присутствует в крови в виде тримеров и гексамеров. При ожирении тримеров становится больше, а гексамеров — меньше, хотя гексамеры гораздо лучше взаимодействуют с клеточными рецепторами. Да и само количество рецепторов при разрастании жировой ткани сокращается. Так что гормона не просто становится меньше, он еще и действует слабее, что, в свою очередь, способствует развитию ожирения. Получается порочный круг. Но его можно разорвать — похудеть килограммов на 12, не меньше, тогда количество рецепторов приходит в норму.
Развитие воспаления и устойчивость к инсулину вызывает и еще один гормон адипоцитов, резистин. Резистин представляет собой антагонист инсулина, под его действием клетки сердечной мышцы снижают потребление глюкозы и накапливают внутриклеточные жиры. А сами адипоциты под влиянием резистина синтезируют намного больше факторов воспаления: хемотаксического для макрофагов белка 1, интерлейкина-6 и фактора некроза опухоли-б (МСР-1, IL-6 и TNF-б). Чем больше резистина в сыворотке, тем выше систолическое давление, шире талия, больше риск развития сердечно-сосудистых заболеваний.
Справедливости ради надо отметить, что разрастающаяся жировая ткань стремится исправить вред, причиняемый ее гормонами. С этой целью адипоциты больных ожирением в избытке производят еще два гормона: висфатин и апелин. Правда, их синтез происходит и в других органах, в том числе в скелетных мышцах и печени. В принципе эти гормоны противостоят развитию метаболического синдрома. Висфатин действует подобно инсулину (связывается с инсулиновым рецептором) и снижает уровень глюкозы в крови, а еще очень сложным образом активирует синтез адипонектина. Но безусловно полезным этот гормон назвать нельзя, поскольку висфатин стимулирует синтез сигналов воспаления. Апелин подавляет секрецию инсулина, связываясь с рецепторами бета-клеток поджелудочной железы, понижает артериальное давление, стимулирует сокращение клеток сердечной мышцы. При уменьшении массы жировой ткани его содержание в крови снижается. К сожалению, апелин и висфатин не могут противостоять действию других адипоцитных гормонов.
Скелетные гормоны
Гормональная активность жировой ткани объясняет, почему избыточный вес приводит к таким серьезным последствиям. Однако недавно ученые обнаружили в организме млекопитающих эндокринный орган покрупнее. Оказывается, наш скелет вырабатывает по крайней мере два гормона. Один регулирует процессы минерализации кости, другой — чувствительность клеток к инсулину.Скелетные гормоны.
Кость заботится о себе
Читатели «Химии и жизни» знают, конечно, что кость живая. Ее строят остеобласты. Эти клетки синтезируют и выделяют большое количество белков, главным образом коллагена, остеокальцина и остеопонтина, создающих органический матрикс кости, который затем минерализуется. При минерализации ионы кальция связываются с неорганическими фосфатами, образуя гидроксиапатит [Ca10(PO)4(OH)2]. Окружив себя минерализованным органическим матриксом, остеобласты превращаются в остеоциты — зрелые, многоотростчатые веретенообразные клетки с крупным округлым ядром и малым количеством органелл. Остеоциты не соприкасаются с кальцинированным матриксом, между ними и стенками их «пещерок» существует зазор шириной около 0,1 мкм, а сами стенки выстланы тонким, 1–2 мкм, слоем неминерализованной ткани. Остеоциты связаны друг с другом длинными отростками, проходящими по специальным канальцам. По этим же канальцам и полостям вокруг остеоцитов циркулирует тканевая жидкость, питающая клетки.
Минерализация кости протекает нормально при соблюдении нескольких условий. Прежде всего необходима определенная концентрация кальция и фосфора в крови. Эти элементы поступают с пищей через кишечник, а выходят с мочой. Поэтому почки, фильтруя мочу, должны задерживать ионы кальция и фосфора в организме (это называется реабсорбцией).
Должное всасывание кальция и фосфора в кишечнике обеспечивает активная форма витамина D (кальцитриол). Она же влияет на синтетическую активность остеобластов. Витамин D превращается в кальцитриол под действием фермента 1б-гидроксилазы, который синтезируется главным образом в почках. Еще один фактор, влияющий на уровень кальция и фосфора в крови и активность остеобластов, — паратиреоидный гормон (ПТГ), продукт паращитовидных желез. ПТГ взаимодействует с костной, почечной и кишечной тканями и ослабляет реабсорбцию.
Но недавно ученые обнаружили еще один фактор, регулирующий минерализацию кости — белок FGF23, фактор роста фибробластов 23. (Большой вклад в эти работы внесли сотрудники фармацевтической исследовательской лаборатории пивоваренной компании «Кирин» и кафедры нефрологии и эндокринологии Токийского университета под руководством Такэёси Ямасита. Синтез FGF23 происходит в остеоцитах, а действует он на почки, контролируя уровень неорганических фосфатов и кальцитриола.
Как выяснили японские ученые, ген FGF23 (здесь и далее гены, в отличие от их белков, обозначаются курсивом) ответствен за две серьезные болезни: аутосомный доминантный гипофосфатемический рахит и остеомаляцию. Если проще, то рахит представляет собой нарушенную минерализацию растущих детских костей. А слово «гипофосфатемический» означает, что болезнь вызвана нехваткой фосфатов в организме. Остеомаляция — это деминерализация (размягчение) кости у взрослых, вызванная нехваткой витамина D. У пациентов, страдающих этими недугами, повышен уровень белка FGF23. Иногда остеомаляция возникает в результате развития опухоли, причем отнюдь не костной. В клетках таких опухолей также повышена экспрессия FGF23.
У всех больных с гиперпродукцией FGF23 понижено содержание фосфора в крови, а почечная реабсорбция ослаблена. Если бы описанные процессы находились под контролем ПТГ, то нарушение фосфорного обмена повлекло бы за собой усиленное образование кальцитриола. Но этого не происходит. При остеомаляции обоих видов концентрация кальцитриола в сыворотке остается низкой. Следовательно, в регуляции фосфорного обмена при этих заболеваниях первую скрипку играет не ПТГ, а FGF23. Как выяснили ученые, этот фермент подавляет синтез 1б-гидроксилазы в почках, поэтому и возникает нехватка активной формы витамина D.
При недостатке FGF23 картина обратная: фосфора в крови в избытке, кальцитриола тоже. Аналогичная ситуация имеет место и у мутантных мышей с повышенным уровнем белка. А у грызунов с отсутствующим геном FGF23 все наоборот: гиперфосфатизация, усиление почечной реабсорбции фосфатов, высокий уровень кальцитриола и повышенная экспрессия 1б-гидроксилазы. В результате исследователи пришли к выводу, что FGF23 регулирует фосфатный обмен и метаболизм витамина D, причем этот путь регуляции отличен от ранее известного пути с участием ПТГ.
В механизмах действия FGF23 ученые сейчас разбираются. Известно, что он сокращает экспрессию белков, отвечающих за поглощение фосфатов в почечных канальцах, а также экспрессию1б-гидроксилазы. Поскольку FGF23 синтезируется в остеоцитах, а действует на клетки почек, попадая туда через кровь, этот белок можно назвать классическим гормоном, хотя кость никто не рискнул бы назвать эндокринной железой.
Уровень гормона зависит от содержания фосфат-ионов в крови, а также от мутаций в некоторых генах, также влияющих на минеральный обмен (FGF23 ведь не единственный ген с такой функцией), и от мутаций в самом гене. Этот белок, как и всякий другой, находится в крови определенное время, а затем расщепляется специальными ферментами. Но если в результате мутации гормон приобретает устойчивость к расщеплению, его станет слишком много. А есть еще ген GALNT3,продукт которого расщепляет белок FGF23. Мутация в этом гене вызывает усиленное расщепление гормона, и при нормальном уровне синтеза больной испытывает недостаток FGF23 со всеми вытекающими последствиями. Есть белок KLOTHO, необходимый для взаимодействия гормона с рецептором. И как-то FGF23 взаимодействует с ПТГ, конечно. Исследователи предполагают, что он подавляет синтез паратиреоидного гормона, хотя до конца в этом не уверены. Но ученые продолжают работу и скоро, видимо, разберут все действия и взаимодействия FGF23 до последней косточки. Подождем.
Скелет и диабет
Безусловно, должная минерализация костей невозможна без поддержания нормального уровня кальция и фосфатов в сыворотке крови. Поэтому вполне объяснимо, что кость «лично» контролирует эти процессы. Но что ей, спрашивается, до чувствительности клеток к инсулину? Однако в 2007 году исследователи из Колумбийского университета (Нью-Йорк) под руководством Джерарда Карсенти обнаружили, к величайшему удивлению научного сообщества, что на чувствительность клеток к инсулину влияет остеокальцин. Это, как мы помним, один из ключевых белков костного матрикса, второй по значению после коллагена, а синтезируют его остеобласты. Сразу после синтеза специальный фермент карбоксилирует три остатка глутаминовой кислоты остеокальцина, то есть вводит в них карбоксильные группы. Именно в таком виде остеокальцин и включается в состав кости. Но часть молекул белка остается некарбоксилированной. Такой остеокальцин обозначают uOCN, он и обладает гормональной активностью. Процесс карбоксилирования остеокальцина усиливает остеотестикулярный белок тирозинфосфатаза (OST-PTP), понижающий, таким образом, активность гормона uOCN.
Началось с того, что американские ученые создали линию «безостеокальцинных» мышей. Синтез костного матрикса у таких животных проходил с большей скоростью, чем у обычных, поэтому кости оказались более массивными, но свои функции выполняли хорошо. У этих же мышей исследователи обнаружили гипергликемию, низкий уровень инсулина, малое количество и пониженную активность вырабатывающих инсулин бета-клеток поджелудочной железы и повышенное содержание висцерального жира. (Жир бывает подкожный и висцеральный, отложенный в брюшной полости. Количество висцерального жира зависит главным образом от питания, а не от генотипа.) Зато у мышей, дефектных по гену OST-PTP, то есть с избыточной активностью uOCN, клиническая картина обратная: слишком много бета-клеток и инсулина, повышенная чувствительность клеток к инсулину, гипогликемия, жира почти нет. После инъекций uOCN у нормальных мышей увеличивается количество бета-клеток, активность синтеза инсулина и чувствительность к нему. Уровень глюкозы приходит в норму. Так что uOCN — это гормон, который синтезируется в остеобластах, действует на клетки поджелудочной железы и мышечные клетки. И влияет он на продукцию инсулина и чувствительность к нему соответственно.
Все это было установлено на мышах, а что же люди? По данным немногочисленных клинических исследований, уровень остеокальцина положительно ассоциируется с чувствительностью к инсулину, и в крови диабетиков он значительно ниже, чем у людей, не страдающих этой болезнью. Правда, в этих исследованиях медики не различали карбоксилированный и некарбоксилированный остеокальцин. В том, какую роль играют эти формы белка в человеческом организме, еще предстоит разбираться.
Но какова роль скелета, оказывается! А мы-то думали — опора для мышц.
FGF23 и остеокальцин — классические гормоны. Они синтезируются в одном органе, а влияют на другие. Однако на их примере видно, что синтез гормонов не всегда есть специфическая функция избранных клеток. Она скорее общебиологическая и присуща любой живой клетке, независимо от ее основной роли в организме.
Это вам будет интересно: Гормоны благополучия
Стерта не только грань между эндокринными и неэндокринными клетками, само понятие «гормон» становится все более расплывчатым. Например, адреналин, дофамин и серотонин, безусловно, гормоны, но они же и нейромедиаторы, ибо действуют и через кровь, и через синапс. А адипонектин оказывает не только эндокринное действие, но и паракринное, то есть действует не только через кровь на отдаленные органы, но и через тканевую жидкость на соседние клетки жировой ткани. Так что предмет эндокринологии меняется на глазах. опубликовано econet.ru
Автор: Наталья Львовна Резник, кандидат биологических наук
Смотрите видео по теме: Химия тела. Гормональный ад и Гормональный рай
Ставьте ЛАЙКИ, делитесь с ДРУЗЬЯМИ!
https://www.youtube.com/channel/UCXd71u0w04qcwk32c8kY2BA/videos
Подпишитесь -https://www.facebook.com/econet.ru/
P.S. И помните, всего лишь изменяя свое потребление - мы вместе изменяем мир! © econet
Источник: https://econet.ru/
Понравилась статья? Напишите свое мнение в комментариях.
Добавить комментарий